El papel del glutatión en la tolerancia al estrés oxidativo y detoxificación de xenobióticos en plantas
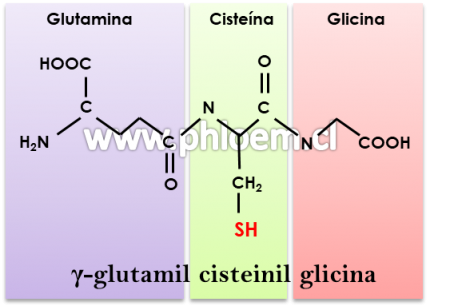
El glutatión es una molécula orgánica con funciones críticas en el desarrollo de meristemas, en la senescencia, en la homeostasis intracelular de las reacciones redox, y en la defensa antioxidante y protección de las plantas contra xenobióticos, entre otras. Estructuralmente es un tripéptido formado por los L-aminoácidos glutamato, cisteína y glicina, en el cual el grupo tiol (-SH) de la cisteína es el responsable de su función química y biológica.
Como se revisó en artículos anteriores [1], este grupo funcional -SH es altamente nucleofílico por lo que tiene la tendencia a ceder electrones cuando reacciona con moléculas electrófilas (que aceptan electrones). Cuando esto sucede, el glutatión (GSH o glutatión reducido) forma disulfuros con el grupo tiol de otras especies químicas, o con otra molécula de glutatión para generar disulfuro de glutatión (GSSG, o glutatión oxidado). Esta oxidación del GSH ocurre por reacciones químicas, o bioquímicas catalizadas por la enzima glutatión peroxidasa (GPX) [2,3] (Figura 1).

GSH es la forma predominante del glutatión cuando la célula se encuentra en homeostasis, ya que un ambiente reducido es necesario para mantener la función celular y estructura de las proteínas. En esta condición la razón GSH:GSSG es cercana a 20:1 [2], y es temporalmente alterada cuando el GSH interacciona con moléculas electrófilas.
El glutatión y la tolerancia al estrés oxidativo
El glutatión es un poderoso antioxidante que contribuye a la detoxificación de especies de oxigeno reactivo (ROS) como el peróxido de hidrógeno (H2O2), y a la neutralización de los radicales superóxido e hidroxilo cuando es oxidado por estos ROS.
Una vez que el GSH ha revertido a GSSG, y a diferencia de las formas oxidadas de otras moléculas que participan en la neutralización de ROS, el GSSG es rápidamente regenerado a GSH por la enzima glutatión reductasa (GR) hasta su nivel de equilibrio (Figura 1). Este mecanismo de reciclaje del GSH funciona como barrera química que previene la propagación de ROS y la oxidación de proteínas, ácidos nucleicos y lípidos, y que es favorecida por la abundancia de GSH en la célula.
El glutatión también está asociado a la regeneración del ascorbato en el ciclo glutatión-ascorbato revisado en un artículo anterior [4]. Esta regeneración juega un papel central en la respuesta de las plantas al estrés oxidativo ya que el ascorbato es la más abundante e importante molécula utilizada por células vegetales para detoxificar el H2O2. Recordemos que el H2O2 es el sustrato del cual se genera el radical hidroxilo, el más potente oxidante en sistemas biológicos [4] .
La alta afinidad del grupo tiol por metales con centros electrófilos le permite al glutatión unirse a metales como cadmio y cobre entre otros, y neutralizar su efecto cuando se encuentran en concentraciones fitotóxicas para la célula. Esta misma función la cumple como sustrato de las fitoquelatinas, una molécula que participa en la detoxificación de metales pesados y en fitoremediación.
El glutatión, los xenobióticos y el papel de la enzima glutatión S-transferasa
Todos los sistemas biológicos tienen la capacidad para neutralizar moléculas ajenas a su metabolismo a través de su biotransformación en compuestos inocuos. La estrategia consiste primeramente en la modificación química o activación del xenobiótico mediante reacciones de oxidación, reducción o hidrólisis, en lo que se conoce como Fase I. Una vez activado, el xenobiótico es conjugado a un carbohidrato, aminoácido o molécula de glutatión para formar compuestos inocuos en Fase II del mecanismo de detoxificación (Figura 2).

La glutatión S-transferasa (GST) es una familia de enzimas que participan en la Fase II de detoxificación de xenobióticos conjugados al glutatión tanto en plantas como en animales. Esta enzima cataliza la transferencia del electrón del GSH hacia un amplio rango de xenobióticos que contienen centros electrófilos formando enlaces covalentes con el átomo de azufre del grupo tiol. El resultado es un conjugado no tóxico que es almacenado en vacuolas, o excretado en el caso de animales, en lo que se conoce como Fase III del mecanismo de detoxificación (Figura 2)
En plantas, el papel del glutatión y de la enzima GST se ha estudiado extensivamente en la detoxificación de moléculas herbicidas con centros electrófilos especialmente en poaceas. La selectividad de los vegetales a este tipo de herbicidas depende de moléculas sintéticas adicionadas en su formulación colectivamente conocidas como “safeners” (antagonistas, antídotos o protectores de la acción del herbicida), cuya función consiste precisamente en estimular la biosíntesis de glutatión y la expresión de la enzima GST u otras enzimas que participan en la detoxificación del xenobiótico en la especie tolerante. Esta estimulación también puede ocurrir en la maleza, y es la causa primaria de la generación de biotipos resistentes.
Una vez conjugados, algunos xenobióticos como los fármacos que entran a los agroecosistemas y son absorbidos por las plantas pueden conservar su actividad biológica mediante de-conjugación o, en el caso de ciertos “safeners”, generar conjugados con mayor actividad biológica relativa al compuesto original [5,6]. Este tipo de conjugados es tema de estudio en ciencias principalmente por las consecuencias toxicológicas que los xenobióticos biotransformados puedan tener en los consumidores de tejidos vegetales.
La importancia del azufre en las funciones del glutatión
El glutatión es uno de los principales metabolitos antioxidantes que utilizan las especies vegetales para tolerar estreses bióticos y abióticos que gatillan la producción de ROS. Asociado a la enzima GST, es único en su capacidad para detoxificar xenobióticos electrófilos en sistemas biológicos.
Puesto que las diversas funciones atribuibles al glutatión se sostienen en el grupo tiol de la cisteína, la capacidad de las plantas para responder al estrés oxidativo o a los xenobióticos va a depender de una adecuada provisión de azufre, la que es posible de diagnosticar utilizando el glutatión como indicador del estatus de este nutriente en los cultivos.
PHLOEM, Octubre 2019
www.phloem.cl
______________________________________________________________________________________________________________
Referencias
- Peñaloza E. 2019. El azufre y la tolerancia de las plantas al estrés ambiental: el papel de la cisteína. Phloem, Junio 2019. www.phloem.cl.
- Noctor G, Mhamdi A, Chaouch S, Han Y, et al. 2012. Glutathione in plants: an integrated overview. Plant Cell Environ. 35: 454–484.
- Hasanuzzaman M, Nahar K, Anee TI, Fujita M. 2017. Glutathione in plants: biosynthesis and physiological role in environmental stress tolerance. Physiol. Mol. Biol. Plants 23: 249–268.
- Peñaloza E. 2018. Estrés oxidativo en plantas; una consecuencia inevitable del metabolismo aeróbico. Phloem, Octubre 2018. www.phloem.cl.
- Sivey JD, Lehmler HJ, Salice CJ, Ricko AN, Cwiertny DM. 2015. Environmental fate and effects of dichloroacetamide herbicide safeners: “Inert” yet biologically active agrochemical ingredients. Environ. Sci. Technol. Lett. 2: 260-269.
- Sun C, Dudley S, McGinnis M, Trumble J, Gan J. 2019. Acetaminophen detoxification in cucumber plants via induction of glutathione S-transferases. Sci. Total Environ. 649: 431–439.